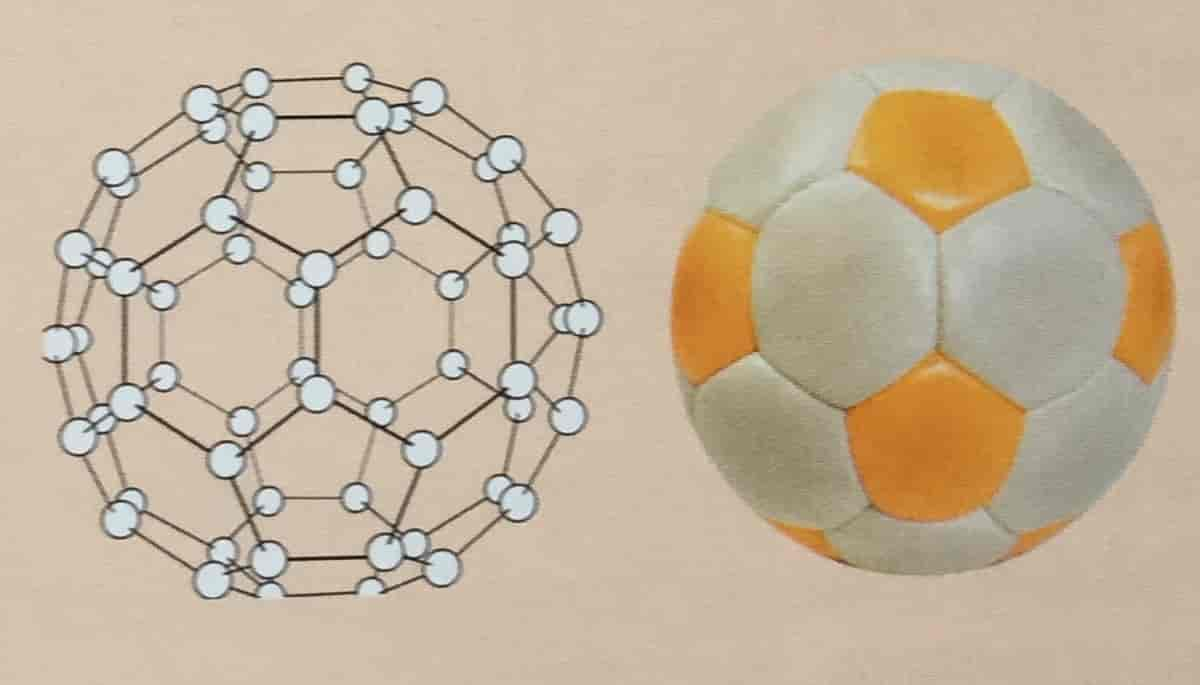
Rein grafitt og diamant er utan lukt og smak. Dei er uløyselege i alle vanlege løysemiddel, mellom anna vatn, bensin, alkohol, fortynna syrar og basar. Fullerenane er derimot løyselege i til dømes heksan og toluen.
Karbon er lite reaktivt ved vanlege temperaturar, men reagerer med dei fleste andre grunnstoff ved høge temperaturar. Karbon kan reagere med oksygen og danne anten karbonmonoksid (CO) eller karbondioksid (CO2). Tendensen karbonet har til å danne oksid gjer karbon til eit godt reduksjonsmiddel av metalloksid.
Karbon blir nytta i form av kol og koks til å framstille metall som jern, kopar, bly, sink, med fleire, ved reduksjon av dei respektive oksida. Ved desse reaksjonane blir først danna karbonmonoksid. Karbon reagerer med vassdamp under danning av karbonmonoksid, karbondioksid og hydrogengass:
\[\ce{C(s) + H2O(g) <=> CO(g) + H2(g)}\]
eller
\[\ce{CO(g) + H2O(g) <=> CO2(g)+ H2(g)}\]
Her står s for solid, det vil seie karbon i fast form, medan g står for gass.
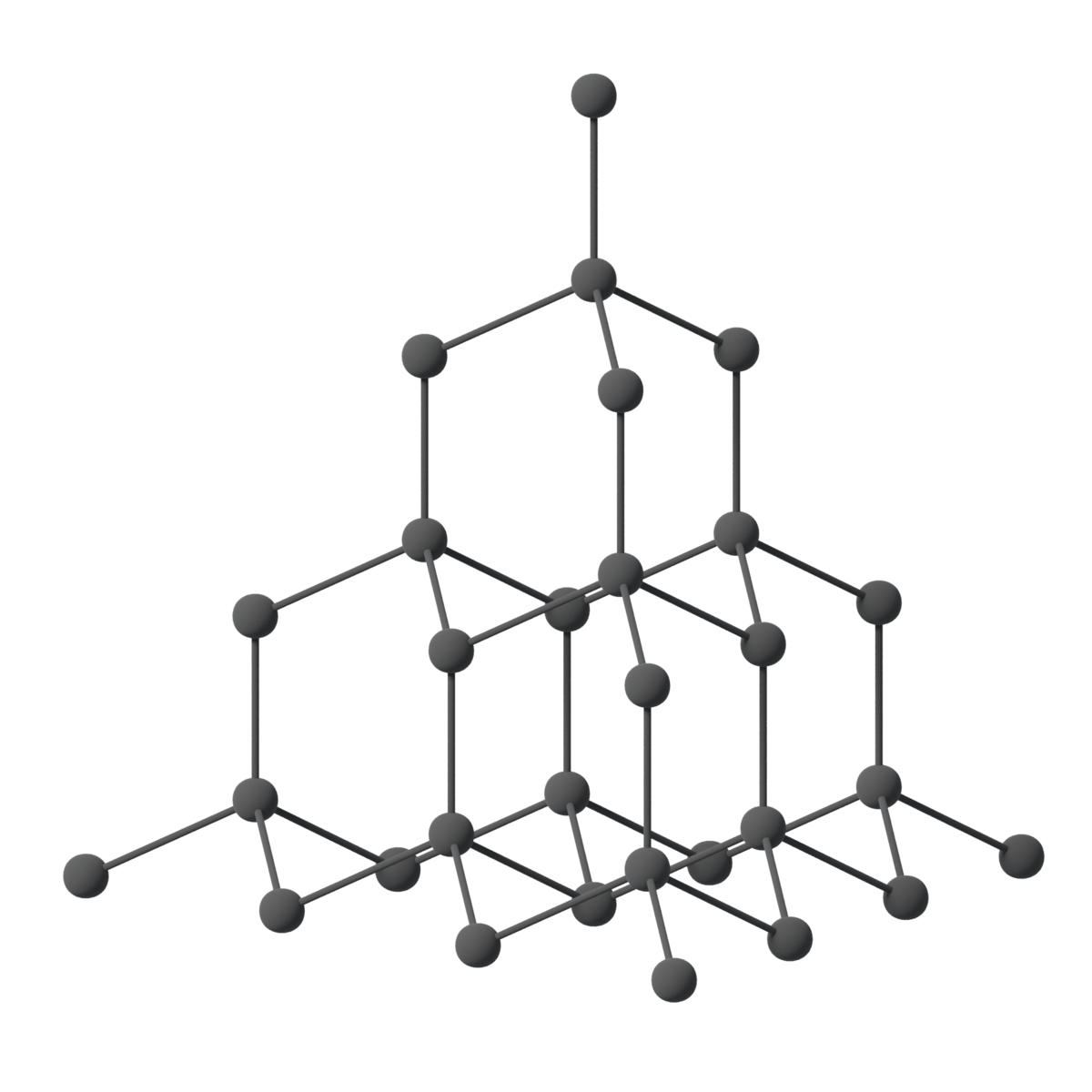
Diamant er det hardaste av alle kjende materiale, og har òg høgast smeltepunkt (rundt 4000 °C) og termisk leidningsevne av alle grunnstoff. Tettleiken er 3,51 gram per milliliter, noko som er er betydeleg større enn for grafitt (2,22 g/mL). Fargelause, vassklare diamantar med høg glans og brytingsevne er reint karbon. Små mengder av andre stoff gjer at diamantar kan ha ulike fargar.
Ved oppvarming i luft til over 800 °C brenn diamant langsamt til CO2. Ved normale trykk og temperaturvilkår er diamant metastabil i forhold til grafitt. Sidan krystallstrukturane er så ulike, krevst oppvarming til over 1200 °C (i fråvær av luft) for å gjere om diamant til grafitt. Diamant er likevel stabil ved høge trykk, og små, kunstige diamantar kan framstillast industrielt ved å utsetje grafitt for høg temperatur (cirka 1750–2000 °C) og høgt trykk (omtrent 100 000 standard atmosfærar).
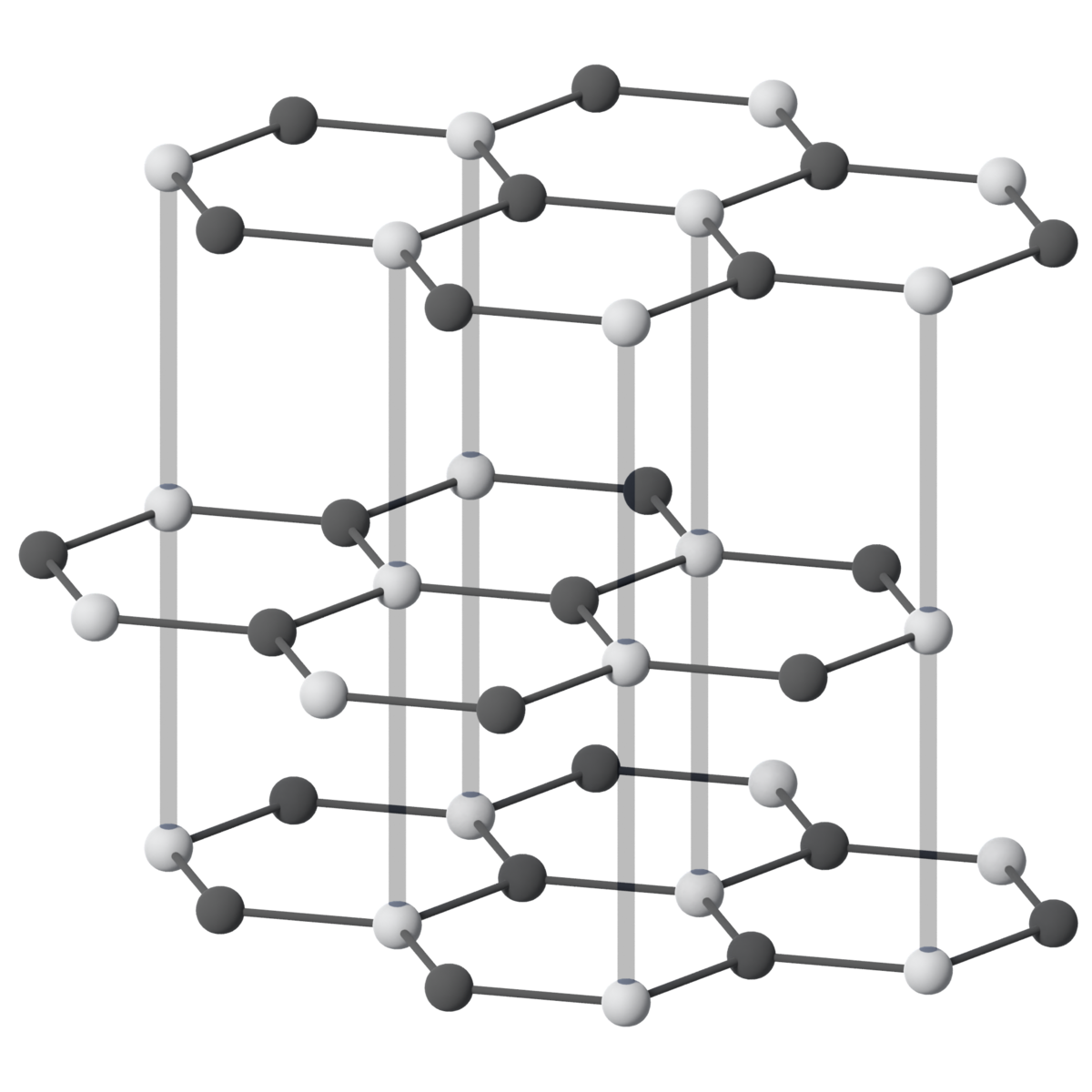
Grafitt leier godt elektrisitet og varme innan laga. Det er litt meir reaktivt enn diamant, og oksiderer langsamt i luft ved temperaturar over 450 °C.







Kommentarar
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.